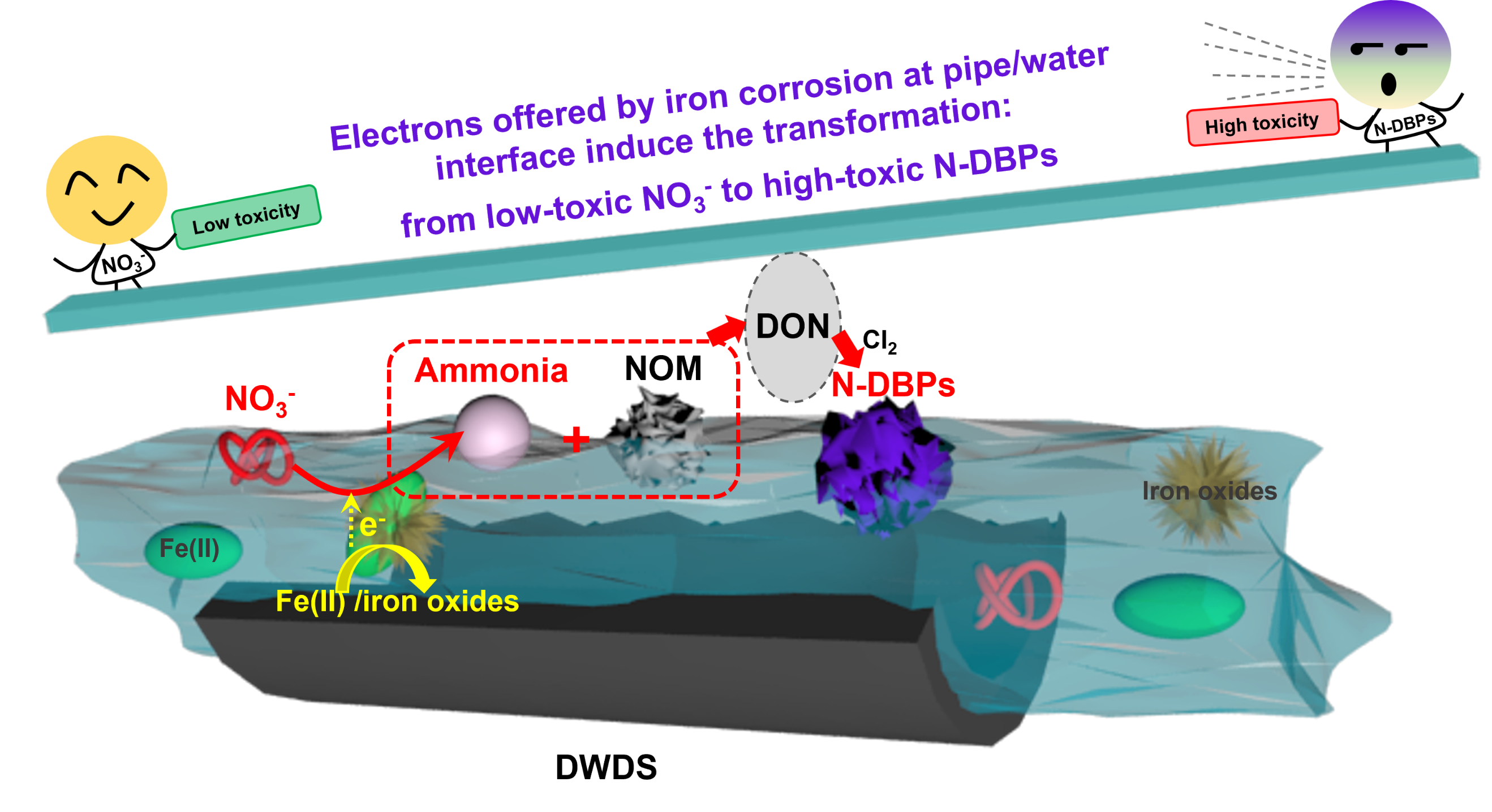
成果概况
含氮消毒副产物(N-DBPs)是饮用水中的高毒性污染物。虽然NO3-不能直接与氯反应产生N-DBPs,但本研究发现NO3-可以促进腐蚀铁管中N-DBPs的形成,同时大多数新产生的N-DBPs具有芳香类结构。Fe(II)与天然有机物之间形成的Fe−O−C键促进了以吡咯N为中间体N物种的N转化电子转移过程。密度泛函计算证实,Fe(II)和铁氧化物共存有效地降低了NO3-还原的吉布斯自由能。在无内衬铸铁管中,水样的细胞存活率从74.3%(空白)大幅下降到45.4%(高NO3-时),进一步证实了高毒性N-DBPs的生成。因此,在发生铁腐蚀的饮用水输配系统中,低毒的NO3-可能通过转化生成N-DBPs,增加水质风险。 第一作者庄媛(第12批会员)/青促会地学分会副会长/生态环境研究中心小组组长。 研究背景 近年来,各国饮用水水质标准对常规含碳DBPs进行了日益严格的控制。然而含氮消毒副产物(N-DBPs)虽然浓度远低于含碳DBPs,但其毒性效应远高于后者。大量研究证实,N-DBPs具有致突变性、细胞毒性和遗传毒性,卤代乙腈(HANs)是最常见的一类N-DBPs。 饮用水在到达用户龙头之前需要经过管网的输配过程,且铁质管道和管件在管网系统中大量使用。饮用水在输配过程中容易因为铁腐蚀、铁释放而产生Fe(II)和铁颗粒物,特别是在腐蚀管垢与水接触的界面区域,Fe(II)和铁氧化物可以大量共存。以往研究发现,饮用水中的铁氧化物在一些情形下会促进消毒副产物生成,然而,以往的研究主要关注金属氧化物对含碳DBPs的影响,N-DBPs在铁氧化物界面的生成与转化机制尚不明确,给水管网输配过程中氮的迁移转化对N-DBPs生成有何影响尚不清楚。 研究结果 在腐蚀的无内衬铸铁管中,“NO3--Rich”条件下(20 mg/L,以N计。参照《生活饮用水卫生标准》GB5749-2022规定,小型集中式供水和分散式供水因水源与净水技术受限时硝酸盐含量限值为20 mg/L)管道中HANs比空白样品“Blank”中显著增加(p<0.05)(图1a)。为了区分不同铁物种在饮用水条件下对N-DBPs生成的贡献,在烧杯中研究了含有不同铁物种HANs的生成(图1b)。在单一铁物种存在下,包括FeOOH(F1)、Fe3O4(F2)和Fe(II)(F3),NO3-对HANs的生成没有明显影响。而Fe(II)和铁氧化物(M1和M2)的共存显著促进了“NO3--Rich”条件下HANs的生成(p<0.05),“NO3--Rich”条件下M1和M2的HANs分别比“Ctrl”提高了21.15%和27.05%。 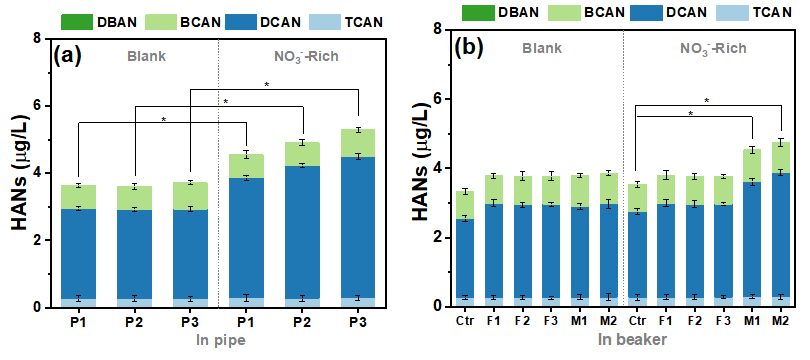
图1 HANs浓度, (a) P1-P3管道 (“Blank”为不额外添加硝酸盐的龙头水,“NO3--Rich”为NO3--N 20 mg/L), (b) 烧杯中 (Ctrl: 不额外添加铁物种, F1: 0.5 mM FeOOH, F2: 0.5 mM Fe3O4, F3: 0.5 mM Fe(II), M1: 0.25 mM Fe(II)+ 0.25 mM FeOOH, M2: 0.25 mM Fe(II)+ 0.25 mM Fe3O4). (“Blank”为不额外添加硝酸盐的龙头水,“NO3--Rich”为NO3--N 20 mg/L;初始氯浓度1.0 mg/L, pH 7.0, 温度25°C, 反应时间24 h; **为 p < 0.01, *为 p < 0.05,误差棒为3次平行)
在三个铁管道中,P3的N-DBPs种类最多。在“Blank”条件下,P3中共鉴定出39个N-DBP,包括4个DBP-1N(含一个氮的N-DBPs)、32个DBP-2N(含两个氮的N-DBPs)和3个DBP-3N(含三个氮的N-DBPs)。在P3中,“NO3--Rich”条件下的N-DBPs高于“Blank”。在三种管道中,P3具有最高的总铁浓度,由此推测,包括Fe(II)和铁氧化物在内的铁腐蚀产物在N-DBPs的形成中发挥关键作用。“Blank”样品中产生的N-DBPs主要由高含氧化合物类组成,具有富含羧酸的脂环族分子结构,但值得注意的是,“NO3--Rich”样品中生成的N-DBPs大多分布在0.1≤O/C<0.67的范围内,其具有芳香结构,而芳香族DBPs表现出比脂肪族DBPs具有高数十至数百倍的毒性。因此,“NO3--Rich”样品中的毒性风险由于产生的N-DBPs而大大增加,尤其是具有芳香结构的N-DBPs。 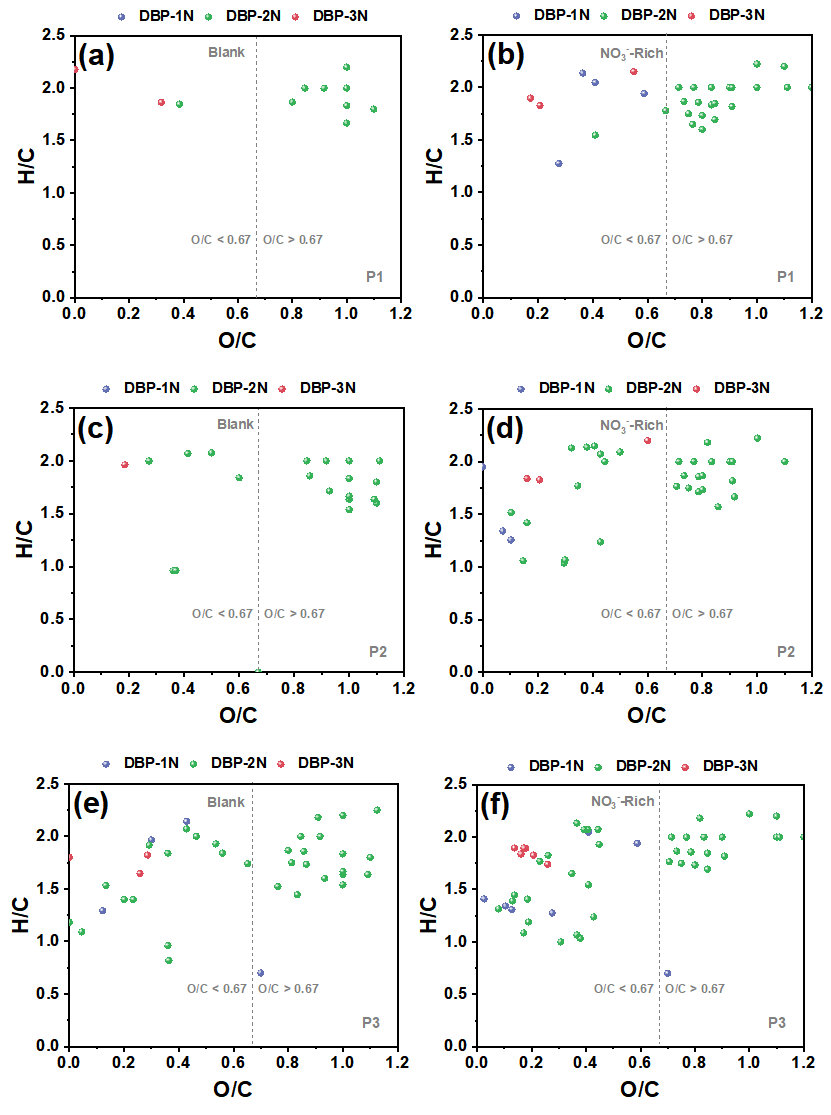
Figure 2 FT-ICR非靶向分析含氮氯化物van Krevelen图, (a) P1管道“Blank”, (b) P1管道“NO3--Rich”, (c) P2管道“Blank”, (d) P2管道“NO3--Rich”, (e) P3管道“Blank”, (f) P3管道“NO3--Rich”.
同位素实验表明,烧杯中0.25 mM Fe(II)+ 0.25 mM FeOOH共存时,15N NO3- 可转化为15N氨氮,转化率为28%。 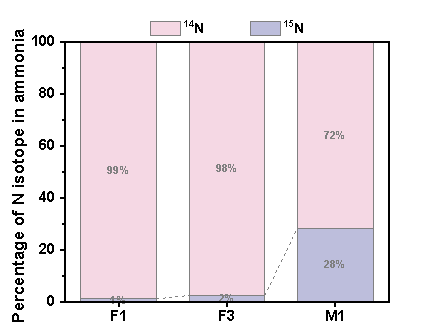
图3 F1、F3和M1水样氨氮中14N和15N比例. (F1: 0.5 mM FeOOH, F3: 0.5 mM Fe(II), M1: 0.25 mM Fe(II)+ 0.25 mM FeOOH,NO3--N 20 mg/L). (初始15NO3--N 20 mg/L;初始氯浓度1.0 mg/L, pH 7.0, 温度25°C)
“NO3--Rich -”情形下,管道颗粒物形成了更强的Fe−O−C键,有助于提升铁颗粒物对DBPs生成的催化效果。“NO3--Rich”情形下,体系中可以检测到吡咯态N,而在“空白”体系中检测不到N物种,表明氮转化后形成的具有吡咯态的DON与铁具有良好的结合能力。 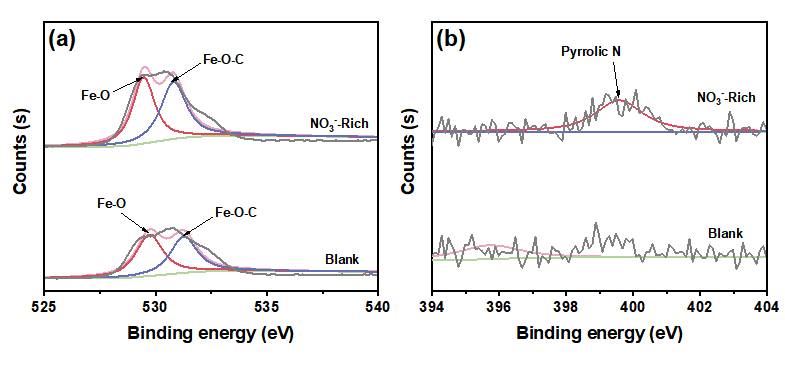
图4 (a) XPS Fe 2p图谱,(b) XPS N1s图谱.
MTT细胞毒性实验表明,“高NO3-”情形下,细胞存活率由74.3 %降至45.4 %,推测上述芳香性N-DBPs的生成对于毒性提升具有重要贡献。 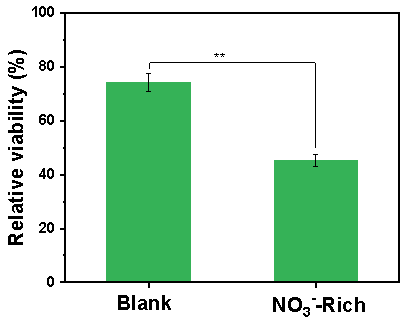
图5 P3管道水样细胞存活率. (人类健康胃上皮细胞)
本研究由国家自然科学基金 (51978652, “给水管网中金属元素形态及其微生物/有机物共存沉积物对消毒副产物生成与转化影响机制” )、中国科学院青年创新促进会项目(2022044,“给水管网中铁颗粒物形成机制及其健康风险”)、中国科学院饮用水重点实验室自由课题(“饮用水中铁介导消毒副产物产生机制及其水质风险”)资助完成。 环境意义 研究结果对给水管网中铁颗粒物的风险提供了重要启示,除了铁颗粒引起的变色外,它还可以通过诱导NO3-转化生成高毒性N-DBPs进一步增加水质风险。此外,低毒性NO3-导致高毒性N-DBPs的增加,也揭示了饮用水中NO3-的新风险。因此,当给水管网中NO3-浓度较高伴随管道铁腐蚀发生时,NO3-可能通过转化为N-DBPs提升输配过程水质风险。 主要作者简介 
庄媛,中国科学院生态环境研究中心副研究员。2016年博士毕业于同济大学。研究方向为给水管网水质转化机制及其控制技术,已以第一/通讯作者在Environmental Science & Technology、Water Research、Applied Catalysis B: Environmental等发表论文57篇(其中第一作者37篇,均为唯一第一作者),第一发明人授权专利19项(其中13项为发明专利)。担任中科院青年创新促进会地学分会副会长/生态环境研究中心小组组长、国际水协会中国青年委员会委员、《环境工程学报》特邀学术编辑&青年编委、Chinese Chemical Letters青年编委、中国城市科学研究会会员、中国科学院汤鸿霄水质学青年突击队副队长、中国科学院生态中心环境水质学国家重点实验室青创小组副组长、中国科学院大学心理辅导员等。获国际水协 “首创水星”新人银奖、安徽省科技进步三等奖(本人排名3/6)、第三届中国城市水环境与水生态大会优秀论文奖、第九届国家自然科学基金委“环境工程青年论坛”优秀报告奖、中国科学院“科技创新先锋团队”表彰(本人排名7/10)、第四届中国科学院“发现科学之美”优秀奖、中国科学院生态环境研究中心“优秀党务工作者”等。
报道来源:中国科学院饮用水科学与技术重点实验室https://dwst.rcees.ac.cn/index.php/news/show/id/171.html 文章链接:https://pubs.acs.org/doi/10.1021/acs.est.3c02507
| 