近日,中国科学院遗传与发育生物学研究所李家洋团队在多亚基SCF E3连接酶的体外重组研究中取得重要进展,相关成果以“An engineered platform for reconstituting functional multisubunit SCF E3 ligase in vitro”为题,于2022年6月24日在国际学术期刊Molecular Plant杂志在线发表(DOI: 10.1016/j.molp.2022.06.011) 蛋白质合成与降解间的平衡,对于维持细胞内稳态及机体的正常功能具有重要作用。泛素-蛋白酶体途径是真核细胞中蛋白降解的主要途径之一,目标蛋白的泛素化修饰由泛素活化酶(E1)、泛素结合酶(E2)和泛素连接酶(E3)协同完成。SCF (SKP1/Cullin1/F-box) E3连接酶是一类多亚基RING E3连接酶,由SKP1蛋白、Cullin1蛋白、RBX1蛋白和可变的F-box蛋白组成,广泛存在于真核生物中,在生长发育和胁迫应答中发挥至关重要的作用。 建立体外泛素化修饰检测系统对于研究E3泛素连接酶和底物蛋白的特异识别关系及其在生长发育中的分子机理十分重要。然而由于多亚基SCF E3泛素连接酶的组成比较复杂,获得具有活性的E3复合体组分并鉴定与其特异协同工作的E2存在较大困难,到目前为止,植物来源的多亚基SCF E3泛素连接酶的体外活性重组体系仍然是空白。 李家洋团队长期从事植物激素独脚金内酯相关分子机理研究,前期研究发现在独脚金内酯信号通路中,独脚金内酯促进其受体蛋白D14与F-box蛋白D3以及底物蛋白D53互作,SCFD3 E3连接酶进而对D53蛋白进行泛素化修饰和降解,解除D53蛋白对下游基因转录的抑制作用(Jiang et al., Nature 2013; Wang et al., Nature 2020)。其中,D53蛋白的泛素化是独脚金内酯信号转导的关键事件。 为深入研究SCF E3连接酶对底物蛋白进行泛素化修饰的作用机理,研究团队以水稻的SCFD3 E3连接酶为出发点,通过质谱鉴定了SCFD3 E3复合体组分并在原核、真核系统中进行了表达纯化,进一步筛选了能与SCFD3 E3连接酶协同工作的E2,并在体外重组了有活性的SCFD3 E3连接酶。为提高重组效率,研究团队设计了串联融合蛋白SKP1-Cullin1-RBX1 (eSCR),并利用eSCR融合蛋白在体外重组了有活性的eSCFD3 E3连接酶。SCFD3 E3和eSCFD3 E3连接酶均能在体外催化底物蛋白D53的泛素化修饰,加入受体蛋白D14和独脚金内酯人工合成类似物rac-GR24能够进一步增强D53蛋白的泛素化水平,与内源独脚金内酯信号传导相一致,说明利用该体外系统能够反映内源独脚金内酯信号转导的状态,为深入研究不同植物中独脚金内酯信号转导途径提供了新的技术体系。 该研究进一步以eSCR为骨架蛋白,与水稻赤霉素信号途径的F-box蛋白GID2重组,获得了有活性的eSCFGID2 E3泛素连接酶;与调控人类肿瘤发生的关键F-box蛋白CDC4和调控人类细胞分裂过程的关键F-box蛋白Fbxl18分别进行体外重组,获得有活性的eSCFCDC4 E3和eSCFFbx118 E3泛素连接酶,其中,eSCFCDC4 E3能够在体外对其底物蛋白HsSic1进行泛素化修饰。因此,该技术在真核生物多亚基SCF E3泛素连接酶研究中具有广泛的应用前景。 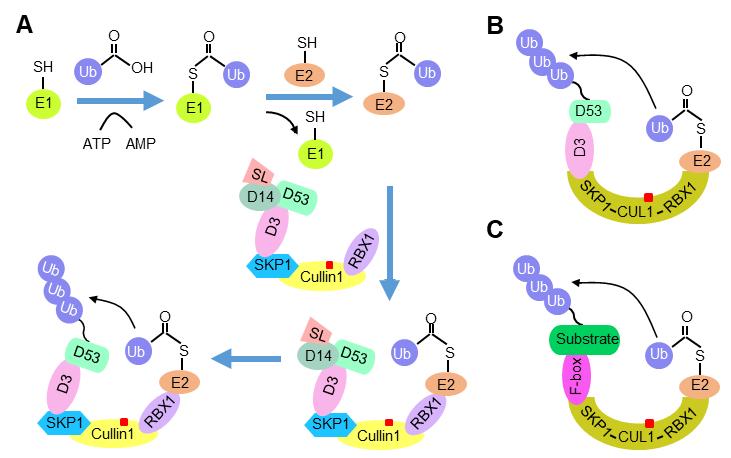
图:多亚基SCF E3泛素连接酶体外活性重组方法技术平台展示 (A)利用表达纯化的SKP1、Cullin1、RBX1、D3、OsUb、OsE1和OsE2(OsUBC14),在体外重组有活性的SCFD3 E3泛素连接酶。(B)利用SKP1-Cullin1-RBX1 (eSCR)融合蛋白,在体外重组有活性的eSCFD3 E3泛素连接酶。(C) eSCR融合蛋白能够与不同的F-box重组出多种eSCF E3,在体外实现底物蛋白的泛素化修饰。红色方块代表NEDD8修饰。 本项成果为解析多亚基SCF E3泛素连接酶与其底物蛋白的特异性识别关系提供了可靠的系统,为研究激素信号转导机制、鉴定癌症治疗靶标及其他生物学过程提供了重要的平台。 中国科学院遗传与发育生物学研究所为该论文第一单位,刘会会博士为论文的第一作者,李家洋研究员和王冰青年研究员(第9批会员)为共同通讯作者。汪迎春研究员、黄夏禾工程师和于菲菲教授参与了本项目的研究。研究得到了国家自然科学基金和中国科学院青促会的资助。 | 